基因突变检测技术 原理、应用与未来展望
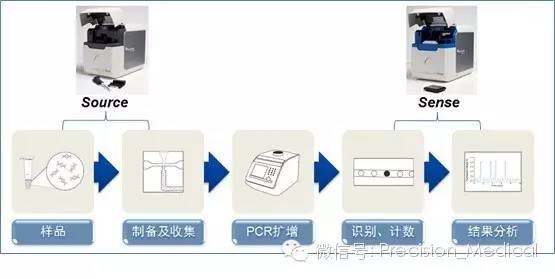
基因突变检测技术是现代分子生物学和医学领域的重要支柱,它不仅深化了我们对遗传疾病、癌症等疾病机制的理解,还为个性化医疗和精准治疗提供了关键工具。随着技术的飞速发展,基因突变检测正从实验室走向临床,成为健康管理不可或缺的一环。
一、基因突变检测的核心技术
目前,主流的基因突变检测技术主要基于测序和芯片平台,具体包括:
- Sanger测序:作为第一代测序技术的代表,以其高准确度被视为“金标准”,常用于验证特定基因区域的突变,但通量较低、成本相对较高。
- 下一代测序(NGS):也称为高通量测序,能同时对多个基因甚至全基因组进行测序,大幅提高了检测效率和范围。NGS技术包括全基因组测序(WGS)、全外显子组测序(WES)和靶向测序,广泛应用于癌症基因panel检测、遗传病筛查及病原体鉴定等领域。
- 数字PCR(dPCR):通过将样本分割成大量微反应单元,实现绝对定量检测,特别适用于低频突变(如液体活检中的循环肿瘤DNA)和拷贝数变异分析,灵敏度极高。
- 基因芯片技术:利用杂交原理快速检测已知突变或单核苷酸多态性(SNP),常用于遗传病携带者筛查和药物基因组学分析,具有高通量、低成本的优势。
二、技术选择的关键考量因素
在选择适合的检测技术时,需综合评估以下方面:
- 检测目标:明确需要检测的突变类型(如点突变、插入/缺失、拷贝数变异等)和基因范围(单个基因、基因panel或全基因组)。
- 样本类型与质量:不同技术对DNA/RNA的质和量要求各异,例如FFPE样本可能更适合靶向NGS,而液体活检常依赖dPCR或NGS。
- 灵敏度与特异性:临床应用中,检测低频突变需高灵敏度技术(如下一代测序),而筛查常见变异则可选择平衡成本与准确性的方法。
- 成本与时间:预算和报告周期也是重要考量,例如NGS成本已显著降低,但数据分析耗时较长;芯片技术则能快速出具结果。
- 临床验证与合规性:确保所选技术经过临床验证,并符合当地监管要求(如FDA批准或CE认证)。
三、应用场景与案例解析
- 肿瘤精准医疗:通过检测肿瘤组织或血液中的基因突变(如EGFR、KRAS、BRAF等),指导靶向药物选择,评估疗效与耐药机制。例如,非小细胞肺癌患者常接受EGFR突变检测以匹配TKI类药物。
- 遗传病诊断与预防:对疑似遗传病患者(如囊性纤维化、亨廷顿病)进行基因检测,明确病因;携带者筛查可帮助家庭评估生育风险,辅助生殖决策。
- 药物基因组学:检测与药物代谢相关的基因变异(如CYP450家族),实现个体化用药,提高疗效并减少不良反应。
- 感染性疾病监测:针对病毒或细菌的基因突变(如新冠病毒变异株),追踪传播路径并评估疫苗有效性。
四、技术挑战与发展趋势
尽管基因突变检测技术日益成熟,仍面临一些挑战:
- 数据解读复杂性:检测出的变异中,许多意义未明,需要结合临床表型和数据库(如ClinVar)进行综合解读。
- 标准化与质控:不同实验室的流程差异可能导致结果不一致,推动标准化协议和室间质评至关重要。
- 伦理与隐私问题:基因数据涉及个人隐私,需建立严格的数据安全和使用规范。
基因突变检测技术将呈现以下趋势:
- 多组学整合:结合基因组、转录组、表观组数据,提供更全面的生物学洞察。
- 人工智能赋能:利用AI加速突变识别、注释和临床关联分析,提升检测效率与准确性。
- 便携化与即时检测:微型化设备(如纳米孔测序仪)有望实现床旁或家庭检测,推动普惠医疗。
###
基因突变检测技术正以前所未有的速度推动生命科学和医疗健康的变革。对于医疗机构、研究人员和普通民众而言,理解其原理、合理选择技术并关注伦理边界,将最大化发挥其价值。如有具体检测需求或技术咨询,建议结合自身目标与专业机构深入沟通,制定个性化方案。
如若转载,请注明出处:http://www.alystest.com/product/47.html
更新时间:2026-03-01 01:37:15